Es wird geschätzt, dass 40% der amerikanischen Bevölkerung unter Störungen der Schilddrüsenfunktion leidet und Hypothyreose die häufigste Ursache für Beschwerden der Patienten ist, die durch Ärzte in diesem Land beobachtet wurden. (so Barnes und seine Kollegen) Es gibt einige Faktoren, die zur klinischen Schilddrüsendysfunktion beitragen. Zu diesen gehören Erkrankungen, die die Drüse selber oder das System Hypothalamus – Hypophysen – Schilddrüsenachse beeinflussen. Subklinische (latente) Schilddrüsenfehlfunktion, insbesondere deren Unterfunktion ist häufiger verbreitet als die klinische Pathologie. (…)
Krankheiten verbunden mit Hypothyreose
Schwere, klinische Schilddrüseninsuffizienz wird mit vielen Krankheiten in Verbindung gebracht, darunter: Myxödem, Kretinismus bei Kindern, Ernte, Atherosklerose und Hyperlipidämie. Subklinische Hypothyreose ist häufiger und nicht immer einfach zu diagnostizieren im normalen Testverfahren. Latente Hypothyreose (subklinische) sollte eher als ein Syndrom und keine Krankheit gesehen werden. Sie wird durch Müdigkeit, Depression, Empfindlichkeit gegenüber Kälte, Hautveränderungen und Veränderungen in der Struktur des Haares ausgezeichnet. Chronische Müdigkeit erscheint in der Regel als harmlos, entstehend aus der Notwendigkeit eines zusätzlichen Schlafs. Oft kommt es auch zur Depression, die mit jeder Episode länger wird. Kälteempfindlichkeit erscheint zuerst in den Gliedern. Kalte Hände und Füße sind auch im Sommer zu spüren. Die Haut wird trocken und rau oder das Haar dünn mit Tendenz zum Ausfall.
Ernährungsmängel und Hypothyreose
Es gibt mehrere Ernährungsmängel, die eine subklinische Hypothyreose begleiten. Am häufigsten wird ein Eisenmangel diagnostiziert. Die daraus resultierende Anämie kann in einer normochromatischen, normozytären, hypochromischen, mikrozytären, makrozytären oder megaloblastischen Form auftreten. Es wird geschätzt, dass Anämie etwa 60% der Patienten mit Schilddrüsenunterfunktion begleitet und nicht mit der Intensität und Dauer der Unterfunktion verbunden ist. Andere Begleiterscheinungen bei Hypothyreose sind Proteinmangel – wahrscheinlich wegen der dazugehörenden Hypochlorhydrie (Defizit von Salzsäure im Magensaft), Mangel an Vitaminen A, C, B6, B5, B1 und Mineralstoffen: Phosphor (P), Mangan (Mn), Magnesium (Mg), Kalium (K), Natrium (Na) und Chrom (Cr). Keyvani und seine Kollegen haben festgestellt, dass ein geringes Niveau an Vitamin A mit dem erhöhten Auftreten von Kropf bei Menschen unter 18 Jahren in Verbindung gebracht werden kann. Nach der Vollendung des 18 Lebensjahres tritt die Struma häufiger bei Frauen als bei Männern auf, die ein höheres Niveau an Vitamin A aufweisen. Die Prävalenz des Auftretens der Struma bei Frauen kann durch die erhöhte Empfindlichkeit des Gewebes auf Östrogen beim gleichzeitigen Vitamin A-Mangel erklärt werden. Bei Kindern, die mit der Stufe 1 diagnostiziert wurden, wird auch ein Zink-Mangel in Kombination mit einem Mangel an Vitamin A beobachtet.
Die EHA-Untersuchung bestimmt die Konzentrationen von Eisen, Phosphor, Mangan, Magnesium, Kalium, Natrium und Chrom im Körper.
Schilddrüsen-Inhibitoren
Als aller erstes müssen wir einige der natürlich vorkommenden Schilddrüsen-Inhibitoren überprüfen. Sie werden in der Regel bei der Behandlung nicht in Betracht genommen, was die oft langsame Reaktion der Patienten auf synthetische Schilddrüsenhormon-Präparate erklärt. Patienten, denen solche Präparate oder Thyroxin verschrieben wurden, zeigen in der Regel keine Reaktion auf die Behandlung in den ersten sechs Monaten. Durch die Berücksichtigung dieser bekannten Inhibitoren der Schilddrüse kann man eine schnellere Reaktion auf das verschriebene Medikament hervorrufen. Diagramm 1. stellt eine Anzahl von Nährstoffen da, die für ihre antagonistische Wirkung auf die Schilddrüsenfunktion bekannt sind.
Vitamin B12, Kobalt (Co)
Kobalt und Vitamin B12 sind eng miteinander verbunden. Daher kann jedes dieser Nährstoffe einen negativen Einfluss auf die Schilddrüse haben und zur Hypothyreose beitragen. Die Auswirkungen von Kobalt auf die Schilddrüse wurden bei Patienten mit Anämie beobachtet, die mit Kobalt behandelt wurden.
Die EHA-Untersuchung bestimmt die Menge an Kobalt sowie sein Verhältnis zu Kalium und Eisen in Ihrem Körper.
Vitamin D, Calcium (Ca)
Die hemmende Wirkung von Calcium auf die Schilddrüse wurde schon seit dem letzten Jahrhundert vermutet, doch erst spätere Studien haben diese Tatsache bestätigt. Es ist bekannt, dass Calcium die Aktivität der Schilddrüse reduziert und dass die Aufnahme dieses Elements bei Patienten mit Hypothyreose erhöht ist. Vitamin D wird aufgrund seiner synergistischen Verbindung mit Calcium als ein Faktor in Betracht genommen, der die Schilddrüsenfunktion sinkt. Studien haben gezeigt, dass die Metaboliten von Vitamin D3 im Blutserum bei Patienten mit Hypothyreose erhöht und bei Patienten mit Hyperthyreose reduziert sind. (…)
Die EHA-Untersuchung bestimmt die Menge an Calcium und sein Verhältnis zu Magnesium, Phosphor, Kalium, Natrium, Silizium und Eisen in Ihrem Körper.
Lithium (Li)
Hypothyreose ist eine bekannte Nebenwirkung der Therapie mit Lithium. Lithium wirkt sich deutlich auch auf Calcium aus. Studien haben gezeigt, dass Patienten, die mit einer Lithium- Therapie behandelt wurden, erhöhte Calcium-Konzentration im Blutserum haben, während das Niveau an Phosphor sinkt. Dies wird höchstwahrscheinlich durch Hyperthyreose induziert, die wiederum durch Lithium verursacht wird – so Shen und seine Mitarbeiter (…)
Die EHA-Untersuchung bestimmt die Konzentration von Lithium sowie das Verhältnis zu Kalium in Ihrem Körper.
Jod (I)
Jod ist wichtig für die reibungslose Funktion der Schilddrüse, doch seine übermäßige Aufnahme wird zu einem Faktor, der ihrer Arbeit dämpft. Es wurde festgestellt, dass das Auftreten von endemischen Struma in China durch die hohe Jodkonzentration im Trinkwasser verursacht wird. Jod wird seit langem in der Therapie und Behandlung der Hyperthyreose eingesetzt.
Die EHA-Untersuchung bestimmt die Höhe von Jod im Körper.
Kupfer (Cu)
Wegen der engen Beziehung zu Östrogen und des Antagonismus zu Eisen und Zink, kann Kupfer als ein Element betrachtet werden, das die einwandfreie Funktion der Schilddrüse stört. Cecil hat den Zusammenhang zwischen Hypothyreose und Eisenmangel beschrieben. Neuere Studien haben ergeben, dass der Eisenmangel die Schilddrüsefunktion beeinträchtigen kann und dass die Konzentration dieses Elementes im Körper die Aktivität der Schulddrüse wiederspiegeln kann. Es wurde auch festgestellt, dass beim Eisenmangel die Umwandlung von L-Phenylalanin zu L-Tyrosin um bis zu 50% reduziert wird.
Die EHA-Untersuchung bestimmt die Konzentration von Kupfer und dessen Verhältnis zu Zink und Eisen in Ihrem Körper.
Inhibitoren der Schilddrüsenhormone
Hypothyreose kann das Ergebnis einer übermäßigen Aktivität anderer endokriner Drüsen sein. Erhöhte Menge an Hormonen in der Blutbahn, auch wenn diese im normalen serologischen Bereich liegt, kann die Antwort auf die Behandlung der Schilddrüse hemmen oder verringern. Endokrine Drüsen zeigen entgegengesetzte Aktivität, ähnlich wie Vitamine und Mineralstoffe. Ihre Hyperaktivität kann die Arbeit der entgegengesetzten Drüse hemmen und ihre Hypoaktivität kann ihre erhöhte Expression als Ergebnis haben.
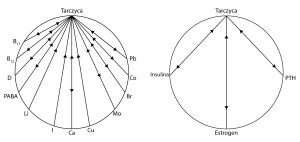 Östrogen
Östrogen
Östrogen ist eng mit dem Kupfer verbunden, das zu gleichzeitigen Schwankungen im Blutserum neigt. Es ist sehr wahrscheinlich, dass sowohl Östrogen als auch Kupfer die Aktivität der Schilddrüse hemmen. Östrogen ist dafür bekannt, dass es die Herstellung vom schilddrüsenstimulierenden Hormon (TSH) durch die Hypophyse verringert. Besonders in der Schwangerschaft, wenn die Konzentration an Kupfer und Östrogen steigt, ist eine vergrößerte Schilddrüse ein weit verbreitetes Phänomen. Es ist auch bekannt, dass eine Schwangerschaft die Hyperthyreose mildert.
Insulin
Insulin steht mit der Produktion von Thyroxin im Wettbewerb. Der Insulinspiegel im Blutserum, der während der Schwangerschaft mit der zunehmenden Östrogenkonzentration steigt, wird auch durch eine Östrogen-Therapie erhöht. Insulin fördert die Synthese von Vitamin D, und vice versa -Vitamin D erhöht die Synthese von Insulin. Man erkennt zunehmend den Zusammenhang zwischen der Häufigkeit von Schilddrüseninsuffizienz bei Diabetikern, die mit Insulin behandelt werden. Die Ergebnisse von Tests mit dieser Verbindung wurden von Gray und seine Kollegen veröffentlicht. Hypothyreose ist die häufigste endokrine Erkrankung bei Kindern. (…)
Calcium ist dafür bekannt, dass es die Freisetzung von Insulin fördert. Der Synergismus zwischen Calcium und Vitamin D kann zur Senkung der Schilddrüsenaktivität beitragen oder durch Stimulation mit Insulin oder aufgrund des Antagonismus von Calcium und Vitamin D zu anderen Nährstoffen, die für die normale Funktion der Schilddrüse notwendig sind.
Parathormon (PTH)
Hormonelle Aktivität des PTH erhöht die Absorption und Retention von Calcium und erhöht dadurch die Produktion von Insulin. PTH-Aktivität wird auch durch Vitamin D verbessert und umgekehrt.
Schilddrüse und Nebenschilddrüsen scheinen die entgegengesetzte Wirkung zu haben. Patienten mit Hypothyreose weisen oft ein subklinisch erhöhtes Parathormon auf, beim gleichzeitig normalem Calciumspiegel im Blutserum. Die PTH-Sekretion wird durch Östrogen erhöht.
Insulin, Östrogen und PTH können als gegenseitige Synergisten betrachtet werden. Sie können einzeln oder gemeinsam im Wettbewerb zueinander stehen oder eine antagonistische Wirkung auf die Schilddrüse haben.
Es sollte beachtet werden, dass auch eine erhöhte Aktivität der Schilddrüse die Aktivität der entgegengesetzten Drüsen hemmen kann. (…)
Wählen Sie das für Sie geeignete Set.
Mineralanalyse des Gewebes (Tissue Mineralanalyse TMA), Testergebnisse und Schilddrüsendysfunktion
Endokrine Drüsen (Hormone) beeinflussen den Stoffwechsel von Spurenelementen und Spurenelemente haben einen Einfluss auf die endokrine Funktion. Daher können die TMA-Testergebnisse bei der Beurteilung der hormonellen Aktivität nützlich sein. Das TMA-Testergebnis, das von Hypothyreose zeugt, ist mit den gestörten Verhältnis der folgenden Elemente verbunden: Calcium / Phosphor (Ca / P), Calcium / Kalium (Ca / K), Calcium / Magnesium (Ca / Mg) und Natrium / Magnesium ( Na / Mg).
Das Ca / P-Verhältnis ist über die Norm erhöht. Dieses Ergebnis war einfach vorherzusagen, denn, wie zuvor geschrieben steigt die Absorption von Calcium bei Hypothyreose, während der Resorption des Phosphors durch die Nieren verringert wird. Die erhöhte PTH-Aktivität ist auch im TMA-Testergebnis sichtbar. PTH erhöht die Absorption von Calcium und Magnesium, während es die Mengen an Phosphor in den Nieren reduziert – ähnlich wie Natrium und Kalium. Das Ca / Mg-Verhältnis kann je nach dem Grad der Beteiligung von PTH erhöht werden.
Die reduzierte Aktivität der Nebennieren zeigt sich im erhöhten Spiegel von Magnesium im Bezug zu Natrium, dh., das Verhältnis von Na / Mg ist gesenkt.
Das Niveau an Kupfer ist oft über dem normalen Bereich erhöht, was auch eine Folge der Nebenniereninsuffizienz ist.
Die erhöhte Insulinsekretion kann im erhöhten Ca / Mg-Verhältnis wiederspiegelt werden, was wiederum dem erhöhten PTH entspricht.
Im Fall von Hyperthyreose zeigen diese Indikatoren einen umgekehrten Trend im TMA-Profil. Die erhöhte Schilddrüsenaktivität steigert die Ausscheidung von Calcium und Magnesium sowie die Phosphor-Retention. Dies ist das Ergebnis des Antagonismus der Schilddrüse und den Nebenschilddrüsen, das wiederum das Ca / P-Verhältnis reduziert – sichtbar im TMA-Profil (Tissue Mineralanalyse).
Die erhöhte Aktivität der Nebennieren zeigt sich im erhöhtem Na / Mg-Verhältnis sowie gesenktem Ca / K-Verhältnis (…)
Die EHA-Untersuchung Konzentration sowie Verhältnisse der Elemente, deren Ungleichgewicht auf die Störungen der Schilddrüsenfunktion hinweisen kann. Dazu gehören die Verhältnisse von: Calcium zu Phosphor, Calcium zu Kalium, Kalzium zu Magnesium und Natrium zu Magnesium.
Achten Sie auf Ihre Gesundheit – bestellen Sie die EHA-Untersuchung.
David L. Watts, D.C., Ph. D., F.A.C.E.P., The Nutritional Relationships of the Thyroid, Journal of Orthomolecular Medicine, Vol. 4, 1989, No. 3, s. 165-169.
Quellen:
1. Barnes BO, Galton L: Hypothyroidism: The Unsuspected Illness. Harper and Roe Pub., N.Y.. 1976.
2. Guyton AC: Medical Physiology. W.B. Saunders, Phil., 1971.
3. Fein HG, Rivlin RS: Anemia in thyroid disease. The Medical Clinics of North America Vol. 59. W.B. Saunders Co., Phil., 1975.
4. Keyvani F, Yassai M, Kimiagar M: International symposium on clinical nutrition and post graduate course. Apr., 1987. Am. J. CI. Nutr., 46,3, 1987.
5. White A, Handler P, Smith EL: Principles of Biochemistry. McGraw-Hill, 1964.
6. Yasaai M, et al: Correlations of serum zinc concentrations with goiter, physical development and serum vitamin A levels. International symposium on clinical nutrition and post graduate course. Apr., 1987, San Diego. Am. J. CI. Nutr., 46,3, 1987.
7. Barker MH: The blood cyanates in the treatment of hypertension. J.A.M.A. 106, 1936.
8. National Research Council. Diet, Nutrition and Cancer. Wash. D.C. Nat. Academy Press, 1982.
9. Eyjolfsson R: Recent advances in the chemistry of cyanogenic glycosides. Zechmeister. Progress in the Chemistry of Organic Natural Products, Vol. 28. Springer Pub. N. Y., 1970.
10.Sederholm T, et al: Cobalt-induced hypothyroidism and polycythemia in lipid nephrosis. Acta Med., Scand., 184, 1944.
11. Washburn TC, Kaplan E: Cobalt therapy and goiter. Clin. Ped., 3, 1964.
12. Kriss P, Carnes WH, Gross RT: Hypothyroidism and thyroid hyperplasia in patients treated with cobalt. J.A.M.A. 157, 1955.
13. Greer MA: Nutrition and Goiter. Physiol. Rev. 30, 1950.
14. Greer MA, Kendall JW, Smith M: Antithyroid compounds. The Thyroid Gland, Vol. I. Pitt, Rivers, Trotter, Eds. Butterworths, Lond. 1964.
15. Lowe CE, Bird ED, Thomas WC: Hypercalcemia in myxedema. /. Clin. Endocrinol. Metab., 22, 1962.
16. Mosekilde L, Lund B, Sorensen OH, Chris tensen MS, Melsen F: Serum 25-hydroxy- cholecalciferol in hypothyroidism. Lancet,I, 1977.
17. Valentzas C, Oreopoulos DG, From G, Porret B, Raporport A: Vitamin D levels in thyrotoxicosis. Lancet, 1977.
18. Danowski TS: Clinical Endocrinology Vol II. Williams and Wilkins, Baltimore, 1962.
19. Cox M, Singer I: Lithium. Disorders of Mineral Metabolism, Vol. I. Bronner, F, Cobkurn, J.W., Eds. Academic Press, N.Y., 1981.
20. Shem F-H, Sherrard DJ: Lithium-induced hyperparathyroidism: An alteration of „set-point”. Ann. of Intern. Med., 96, 1982.
21. Langer P, Greer MA: Antithyroid Substances and Naturally Occurring Goitrogens. S. Keager, Basel, Switz., 1977.
22. Mu L: Endemic goiter in central China caused by excessive iodine intake. Lancet II, 1987.
23. Wolf J, Chaikoff IL: Plasma inorganic iodide as a homeostatic regulator of thyroid function. /. Biol. Chem., 174, 1948.
24. Cecil RL: Textbook of Medicine. Saunders Co., Phil. 1938.
25. Dillman E, et al: Hypothermia in iron deficiency due to altered triiodothyronine metabolism. Am. J. Physiol., 239, 1980.
26. Lehmann WO, Henrich HC: Impaired phenylalanine-tyrosine conversion in patients with iron-deficiency anemia studied by a L(2H5phenylalanine loading test. Am. J. Clin. Nutr., 44, 1986.
27. Watts DL: Nutritional interrelationships, minerals, vitamins, endocrines. (Unpub.) Trace Elements, Inc., Dallas. 1988.
28. Brown JHU: Intergration and Coordination of Metabolic Processes. A Systems Approach to Endocrinology. Van Nostrand Reinhold Co., N.Y., 1978.
29. Innerfield R, Hollander CS: Thyroidal complications of pregnancy. The Medical Clinics of North America, Vol. 61. W. B. Saunders Co., Phil., 1977.
30. Ibid.
31. Selenkow HA, Birnbaum MO, Hollander CS: Thyroid function and dysfunction during pregnancy. Clin. Ob. Gyn. 16, 66, 1973.
32. Spellacy WH, Goetz FC: Plasma insulin in normal and late pregnancy. N.E.J.M., 268, 1963. 33.Gershberg H, et al: Glucose tolerance in women receiving an ovulatory suppressant. Diabet., 13, 1964.
34. Cross HS, Peterlik M: Hormonal and ionic control of phosphate in differentiating en-terocy te.
Progress in Clinical and Biological Research, Vol. 168. Epithelial Calcium and Phosphate Transport, Molecular and Cellular Aspect. Bonner F, Peterlik M, Eds. Alan R. Liss, Inc., N.Y., 1984.
35. Gray RS, Smith AF, Clark BF: Hypercholesterolemia in diabetes with clinically unrecognized primary thyroid failure. Horm. Metab. Res., 13, 1981.
36. Hughes JF: Pediatrics. Mosby Co., St. Louis, 1971.
37. Sheard NF, Walker WA: The role of breast milk in the development of the gastrointestinal tract. Nutr. Rev., 46, 1, 1988.
38. Leclereq-Meyer V, et al: Effect of calcium and magnesium on glucagon secretion. Endocrinol, 93, 1977.
39. Malaisse WJ, et al: The stimulus-secretion coupling of glucose-induced insulin release. /. Lab. Clin. Med.
40. Adams P, et al: Parathyroid function in spontaneous primary hypothyroidism. /. Endocrinol., 40, 1968.
41. Bouillon R, DeMoor P: Para-thyroid function in patients with hyper- or hypothyroidism. /. Clin. Endocrinol. 38, 1974.
42. Greenburg C, et al: Parathyroid hormone secretion effect of estradiol and progesterone. Metabol., 36, 2, 1987.
43.Larsen PR: Thyroid-pituitary interaction. N.E.J.M., 306, 1, 1982.
44. Henkin RI: Trace metals in endocrinology. The Medical Clinics of North America, Vol. 60. W.B. Saunders Co., Phil. 1976.
45. Douglas WW, et al: Effects of alkaline earths and other divalent cations on adrenal medullary secretion. /. Physiol., 175, 1964.
46. Harrop GA, et al: Studies on the suprarenal cortex. /. Exp. Med., 58, 1933.
47. Wacker WE, et al: Magnesium Metabolism. N.E.J.M., 259, 1958.
48. Harden R, et al: Phosphate excretion and parathyroid function in thyrotoxicosis. /. Endocrinol., 28, 1964.
49. Bortz W, et al: Differentiation between thyroid and parathyroid causes of hypercalcemia. Ann. Int. Med., 54, 1961.
50. Malamos B, et al: The renal handling of phosphate in thyroid disease. /. Endocrinol. 45, 1969.
51. Rosa RM, et al: Adrenic modulation of extrarenal potassium disposal. N.E.J.M., 302, 1980.
52. Silva P, et al: Sympathetic systems in potassium homeostasis. Am. J. Physiol., 241, 1981.
53. Clausen T, et al: The effect of catecholamines on Na-K transport and membrane potential in the rat soleus muscle. /. Physiol., 270, 1977.













